NOTICIAS
Resumen: 20º Simposio Internacional de EC

La Sociedad Internacional para el Estudio de la Enfermedad Celíaca (ISSCD) organiza cada dos años un simposio internacional que reúne a los médicos e investigadores más involucrados en esta patología. La 20ª edición se celebró en Sheffield (Reino Unido) el pasado mes de septiembre. Desarrollamos a continuación un amplio resumen de los principales temas abordados.
Epidemiología y factores implicados
La enfermedad celíaca (EC) es un buen ejemplo de enfermedad poligénica y multifactorial, e identificar sus diferentes determinantes genéticos y ambientales es un reto al que se enfrentan los investigadores con diferentes estrategias. Iris Junkers (Groningen, Países Bajos) aborda este reto con la novedosa tecnología de los organoides, que permite simular en el laboratorio y estudiar por separado el funcionamiento del epitelio intestinal y de células asociadas, como los linfocitos intraepiteliales, a partir de biopsias. Sus estudios incluyen personas sanas, personas con EC activa y personas con EC tratada con dieta sin gluten. Desde su punto de vista, los modelos que evalúa corresponden en realidad a intestinos no inflamados (sanos), intestinos severamente inflamados (EC activa) e intestinos levemente inflamados (EC tratada). Así ha podido identificar grupos de genes relacionados con la inflamación que se expresan de forma diferente según el tipo celular (enterocitos o linfocitos intraepiteliales) o según el tipo de paciente (sano / EC activa / EC tratada). Igualmente detecta una composición y actividad diferente en la microbiota de estos perfiles de pacientes, con una evolución a medida que se reduce la inflamación.
A nivel mundial, Govind Makharia (Delhi, India) mostró como datos epidemiológicos promedio que la seroprevalencia de la EC es del 1,4% (casos con anticuerpos positivos en sangre), que la prevalencia de la EC confirmada con biopsia es del 0,7% y que la incidencia es de 12 a 20 nuevos casos por cada 100.000 habitantes al año, registrándose mayor número de casos a mayores latitudes. Desde el punto de vista clínico, la EC se da en 1 de cada 33 casos con síndrome de intestino irritable, en 1 de cada 31 casos con anemia ferropénica y en 1 de cada 10 casos con diarrea crónica o talla baja. En general, los datos epidemiológicos sugieren que la incidencia de la EC va en aumento. En Noruega, la prevalencia de la EC se ha duplicado en los últimos 20 años, pasando del 1% al 2% la población, según expuso Ketil Stordal (Oslo, Noruega), y actualmente son más los casos diagnosticados en edad adulta, aunque probablemente muchos de ellos arrastran la enfermedad desde la infancia.
De hecho, se discute en ocasiones si la EC es una enfermedad pediátrica cuyo diagnóstico en la edad adulta se debe a un retraso en el diagnóstico y no a una manifestación tardía de la patología. Daniel Agardh (Lund, Suecia) presentó varios estudios al respecto. Uno de ellos, realizado en Finlandia, buscó la EC en 2.815 personas adultas en 2002 y nuevamente en 2005, detectando 5 nuevos casos en el grupo estudiado, lo que sugiere que la EC puede presentarse en cualquier momento. Sea como sea, es un hecho que existe una elevada proporción de casos sin diagnosticar en la edad adulta. El cribado serológico de la EC en 7.750 ciudadanos suecos de entre 45 y 76 años halló una seroprevalencia del 1,2% y los casos detectados se caracterizaban por un menor peso corporal (de 2,2 kg de media), un menor riesgo de enfermedad cardiovascular y un mayor índice de osteoporosis. Un estudio similar llevado a cabo en el condado de Olmsted en Minnesota (Estados Unidos) detectó una seroprevalencia del 1,1% en un grupo de 31.255 ciudadanos de entre 18 y 50 años. Los estudios multicéntricos realizados en grupos de población pediátrica han revelado un pico de diagnósticos en el tramo de edad de 1 a 5 años, y es esperable que también exista un pico de diagnósticos en la edad adulta. Para comprobarlo no es necesario seguir durante media vida a las personas sin diagnosticar, basta con analizar de forma retrospectiva los registros sanitarios de la población allá donde los haya. Un ejemplo es Noruega, que tiene abierto un registro voluntario de datos de salud desde 1984 que supera ya los 250.000 participantes, todos ellos habitantes del condado de Trondelag, es el denominado estudio HUNT. Actualmente, la edad mediana de diagnóstico se sitúa en los 52,5 años (es decir, la mitad de los casos han sido diagnosticados por debajo de esa edad y la otra mitad por encima).
Si bien, continúa Stordal, el gluten es el factor ambiental necesario para manifestar la enfermedad, junto con los determinantes genéticos HLA DQ2 y DQ8 (presentes en el 48% de la población noruega), no se considera que sea el factor detonante (trigger), sino el que mantiene activa la enfermedad una vez presentada (driver). Los estudios epidemiológicos longitudinales, que hacen un seguimiento de las personas con predisposición genética durante periodos de tiempo largos, han detectado que la mayor incidencia de casos de EC se da entre los 18 meses y los 5 años de vida. Entre los posibles factores ambientales detonantes se han identificado ciertos agentes infecciosos. La mayor incidencia de infecciones digestivas y respiratorias se produce en los primeros 18 meses de vida, y el número de episodios infecciosos previos al diagnóstico de la EC (0-3 / 3-5 / 5-10 / >10) parece igualmente relevante. Los principales agentes infecciosos implicados son los parechovirus, los enterovirus y especialmente los rotavirus, y la aparición de los anticuerpos específicos de EC en sangre en los casos diagnosticados ocurre con más frecuencia en los 3 primeros meses posteriores a la infección.

La exposición fetal al gluten
Alfonso Rodríguez Herrera (Dublín, Irlanda) investiga si la exposición fetal al gluten influye en el riesgo de desarrollo de la EC, ya sea como factor protector o como factor de riesgo. Se ha demostrado la presencia de péptidos inmunogénicos de gluten (GIP) en el líquido amniótico de mujeres embarazadas sanas, pero no si son celíacas y hacen dieta sin gluten, y la cantidad de gluten detectada (en las sanas) no depende de la edad gestacional sino de la cantidad de gluten ingerida. El flujo de GIP intrauterino implica su tránsito por las vías respiratorias y el tracto digestivo fetal y su excreción por vía digestiva y orina de vuelta al líquido amniótico. Se desconoce por ahora su impacto en la función inmunitaria.
La microbiota intestinal
El análisis de la microbiota intestinal en estos estudios longitudinales también resulta interesante. Como mostró Eric Tripplet (Florida, Estados Unidos), su caracterización a partir de las heces de bebés con predisposición genética a EC analizadas durante 4 años, entre los 3 y los 48 meses de vida, confirma que los casos con EC tienen disbiosis intestinal, con una menor presencia de grupos bacterianos antiinflamatorios (bifidobacterias, bacteroides, fecalobacterias y Akermansia), que se detecta hasta 6 meses antes de la aparición de los anticuerpos específicos de EC sangre. Se comprueba, además, que la EC se manifiesta antes o después según predominen más o menos grupos bacterianos proinflamatorios.
Alberto Caminero (Ontario, Canadá) repasó los mecanismos bacterianos que pueden influir en el desarrollo de la EC en el intestino. Por un lado, contribuyen a la digestión del gluten, incluso con mayor eficacia que nuestro propio aparato digestivo, y ocurre en diferentes localizaciones (boca, duodeno y colon). Así pueden incrementar o reducir la toxicidad de los fragmentos de gluten generados. Por otro lado, algunas proteasas de origen bacteriano, como la enzima elastasa (LasB) de Pseudomonas aeruginosa, además de contribuir en la degradación de gluten aumentando su toxicidad, tiene capacidad para activar la respuesta inmune innata intestinal al margen del gluten, produciendo inflamación. El procesamiento bacteriano del gluten puede influir también en la interacción entre las células epiteliales intestinales y los linfocitos T. Y el metabolismo bacteriano del triptófano también promueve la inflamación intestinal por una menor producción de ligandos para los receptores AhR.
¿Se puede predecir la enfermedad celíaca?
Edwin Liu (Colorado, Estados Unidos) expuso el riesgo acumulado de EC según la carga genética, que es del 0,4%-1,1% para heterocigotos DQ8, 2,3%-7,2% para homocigotos DQ8, 3,0%-9,4% para heterocigotos DQ2/DQ8 y 9,1%-28,3% para homocigotos DQ2. Sobre eso, incrementan el riesgo otros factores genéticos, las infecciones, el país de nacimiento y el consumo de gluten, mientras que lo reducen la vacuna contra el rotavirus o la dieta mediterránea. Hay factores sobre los que no se puede actuar, como la genética, el sexo o el lugar de nacimiento, mientras que otros son objeto de intervención (dieta, infecciones y demás).
Manifestaciones clínicas extradigestivas comunes
Manifestaciones orales
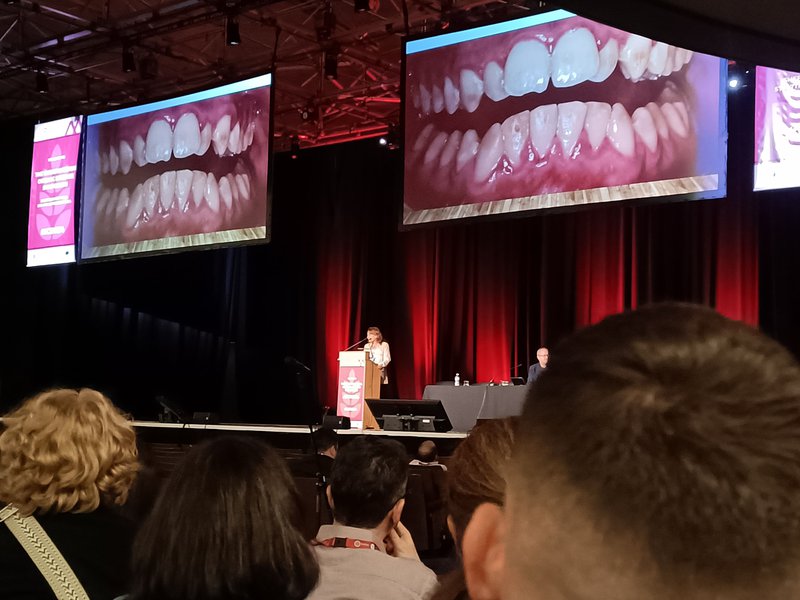
Las manifestaciones orales que pueden darse en la EC incluyen el retraso en la erupción dental (afecta al 30%-48% de casos de EC frente al 3%-10% de la población general), los defectos en el esmalte dental (27% en EC) o las aftas orales, que son comunes en enfermedades autoinmunes y en el caso de la EC afectan al 32% de los pacientes (hasta el 48% en la infancia), frente al 25% en la población general. Sobre el mayor riesgo de caries hay resultados contradictorios y también se contemplan como problemas bucales asociados la lengua geográfica y el liquen plano oral. Estos problemas orales no revierten con la dieta sin gluten, tal como comentó Carolina Ciacci (Salerno, Italia) y entre los mecanismos o factores implicados en ellas se contemplan reacciones inmunitarias contra la formación de los dientes, la composición de la microbiota oral (que es la más poblada tras el intestino y muestra una disbiosis similar en los casos con EC), la saliva y la alimentación.
Hipoesplenismo
La EC es una de las posibles causas de hipoesplenismo, que implica una menor protección mediada por IgM frente a ciertos patógenos. En pacientes con EC se estima que puede llegar a darse en el 60% de los casos y es más probable si padecen alguna otra enfermedad autoinmune, algún tipo de cáncer o han desarrollado EC refractaria. Ello justifica, en palabras de Fabiana Zingone (Padua, Italia), la vacunación frente al neumococo, aunque las recomendaciones han ido variando. En 2014 se recomendaba en todos los casos, en 2019 solo en casos demostrados de hipoesplenismo y en 2024 se ha vuelto a hacer extensiva la recomendación a todos los casos con EC. La respuesta frente a otras bacterias encapsuladas (meningococo y Haemophylus) también está comprometida si existe hipoesplenismo pero no hay recomendación general de vacunación frente a estos patógenos.
Trastornos neurológicos y psiquiátricos
Las neuropatías y las ataxias inducidas por el gluten están reconocidas en las guías clínicas del Reino Unido desde 2015. La ataxia manifiesta realmente no es muy común, según expuso Iain Croal (Escocia, Reino Unido) pero problemas neurológicos más sutiles sí que están más extendidos. Hasta un 67% de pacientes muestran síntomas neurológicos en el momento del diagnóstico de la EC. La presencia de anticuerpos IgG antigliadina son un indicador de su posible vinculación con el gluten, ya que son reactivos frente a componentes del sistema nervioso y también del sistema vascular. Los anticuerpos antitransglutaminasa 6 (TG6), por su parte, son mejores indicadores, estando presentes en el 76% de los casos de ataxia por gluten, en el 32% de los casos con EC y en el 4% de la población general. Su presencia se asocia con una atrofia cerebral más rápida.
La transglutaminasa neuronal (TG6), implicada en los trastornos neurológicos por gluten, guarda un 65% de homología con la transglutaminasa tisular (TG2), implicada en la EC, y con la transglutaminasa epidérmica (TG3), implicada en la dermatitis herpetiforme (DH). Todas ellas pueden desamidar el gluten y abren las puertas a una reacción autoinmune inducida por el gluten con generación de autoanticuerpos dirigidos contra el intestino (anti-TG2 en la EC), la piel (anti-TG3 en la DH) y el sistema nervioso central (anti-TG6 en la ataxia). La TG6 se expresa en regiones del cerebro implicadas en el control de la locomoción. Marios Hadjivassiliou (Sheffield, Reino Unido) destacó la persistencia de anticuerpos IgA anti-TG6 en el 67% de los pacientes con ataxia por gluten (y de IgA antigliadina en el 33%) a pesar de la dieta sin gluten y su desaparición requiere de esteroides o tratamientos inmunosupresores.
En el apartado psiquiátrico, la posible vinculación del gluten con algunos casos de esquizofrenia no está clara. Deanna Kelly (Baltimore, Estados Unidos) comentó la implicación de citoquinas proinflamatorias y de anticuerpos IgG antigliadina, que son más comunes en los casos de esquizofrenia con componente depresivo.
Diagnóstico
Kalle Kurppa (Tampere, Finlandia) recordó que para alcanzar un diagnóstico fiable de la EC es necesario asegurar un consumo normal de gluten en el momento de realizar las pruebas (analítica de sangre y biopsia). En ocasiones, y cada vez con mayor frecuencia, el paciente con sospecha de EC llega a la consulta siendo bajo su consumo en gluten o encontrándose ya a dieta sin gluten, o decide iniciar la dieta sin gluten a raíz de un resultado analítico positivo en anticuerpos sin esperar a la biopsia, cuyos resultados pueden resultar no concluyentes si se demora demasiado. Los motivos que llevan a cada vez más personas a retirar el gluten de la dieta, o a reducir su consumo, son el hecho de convivir con alguna persona celíaca, presentar síntomas de intestino irritable o algún otro problema de salud que le anima a seguir esta dieta. Sea como sea, estos casos son candidatos a una prueba de provocación (reintroducción de gluten en la dieta) antes de someterse a las pruebas de diagnóstico. En niños se recomienda la ingesta de 5-15 gramos de gluten al día durante al menos 3 meses, realizando un control analítico al cabo de un mes y después cada 3 meses hasta completar un año. Si en ese tiempo no se ha producido elevación de anticuerpos en sangre ni se han presentado síntomas compatibles con la EC, se puede mantener la dieta normal con gluten por tiempo indefinido. En adultos, lo aconsejado es consumir 6-10 gramos de gluten al día durante 1-3 meses, según tolerancia.
Sobre la evaluación microscópica de las biopsias, Marie Robert (Connecticut, Estados Unidos) enfatizó la necesidad de disponer de buenos especímenes para su estudio, es decir, biopsias adecuadamente cortadas y orientadas para no confundir una verdadera atrofia vellositaria con una aparente atrofia debida a un mal procesamiento de la muestra. Es fundamental poder seguir la vellosidad desde su ápice hasta la base de su cripta y distinguir bien el límite entre la vellosidad y la cripta. No hay que ignorar el recuento de linfocitos intraepiteliales, que obligatoriamente estarán aumentados si efectivamente existe atrofia causada por la EC.

Diagnóstico sin biopsia
La estrategia de diagnóstico sin biopsia en pediatría está implantada en Europa desde el año 2012. Según datos de los Países Bajos presentados por Luisa Mearin (Leiden, Países Bajos), solo el 42% de los casos diagnosticados de EC en edad pediátrica en ese país requirió biopsia para confirmar el diagnóstico. El único problema que ve es la falta de control por parte de médicos especialistas en gastroenterología pediátrica si el diagnóstico se efectúa en las consultas de Atención Primaria. Se estima que esta estrategia de diagnóstico sin biopsia, aplicada en adultos ahorraría 2,5 millones de libras al año en Reino Unido. Sobre ello discutió Mohamed Shiha (Sheffield, Reino Unido), quien aludió a la Asociación Americana de Gastroenterología para indicar que el valor predictivo positivo para EC basado solo en el resultado serológico de anticuerpos, obviando la biopsia, es del 95%, cifra inaceptable para una enfermedad crónica que requiere un tratamiento de por vida. Algunos estudios elevan esa cifra hasta el 98% y consideran asumible aplicar criterios de diagnóstico sin biopsia en adultos con una probabilidad previa de EC entre media y alta, lo que ahorraría un 75% de los costes de diagnóstico actuales. En la práctica se estima que un tercio de los pacientes adultos con anticuerpos positivos no son derivados al especialista digestivo.
El diagnóstico de la EC sin biopsia en adultos con criterios pediátricos se aplicó temporalmente en adultos durante la pandemia de COVID-19 en algunos países como el Reino Unido. El criterio para evitar la biopsia en la infancia es tener anticuerpos IgA antitransglutminasa en sangre con valores que superen en más de 10 veces el valor normal, confirmando que los anticuerpos IgA antiendomisio son positivos en una segunda analítica de sangre. Un estudio retrospectivo realizado en Estados Unidos y Canadá comprobó que el 83% de los pacientes adultos diagnosticados de EC con biopsia entre 2016 y 2021 tenían anticuerpos positivos en sangre en el momento del diagnóstico. No se pudo establecer ningún límite en el valor de los anticuerpos que garantizara la EC con una certeza del 100%. El límite establecido en pediatría de 10 veces sobre el valor normal arrojaba un valor predictivo positivo (probabilidad de EC) del 95% en la edad adulta en este grupo, y bajaba al 91% en los casos con diabetes tipo 1.
Seguimiento
Es sabido que no existe correlación entre el grado de lesión intestinal y la presencia de síntomas digestivos o su severidad. Personas con atrofia total de vellosidades pueden presentar desde síntomas leves hasta síntomas severos o bien no mostrar ningún síntoma. Por otro lado, las personas celíacas que ya se encuentran a dieta sin gluten pueden seguir presentando síntomas o lesión intestinal después de 6-12 meses de dieta sin gluten. Es más, personas que aún no han recuperado la mucosa intestinal pueden no mostrar ningún síntoma mientras que estos persisten en otras en las que la lesión intestinal ya está reparada. No está claro qué es lo que causa los síntomas, si es el gluten o el hecho de tener activo el sistema inmunitario, con anticuerpos antitransglutaminasa y liberación de citoquinas proinflamatorias. Lo que sí está claro es que el daño intestinal por sí mismo se asocia con un mayor riesgo de osteoporosis, pérdida de peso e incluso linfoma intestinal, expuso Jeremy Woodward (Cambridge, Reino Unido).
Las biopsias de control tras el diagnóstico están especialmente indicadas cuando hay incertidumbre sobre la recuperación de la lesión intestinal, ya sea por la persistencia de anticuerpos positivos en sangre, por la persistencia o reaparición de los síntomas iniciales o por la aparición de nuevos síntomas sin otra causa aparente, situaciones que se dan hasta en el 30% de los casos. Según Marie Robert (Connecticut, Estados Unidos), habría que esperar al menos 1 año antes de plantearse repetir la biopsia y el hallazgo de lesiones podría deberse a errores en la dieta sin gluten, al consumo de ciertos fármacos, a infecciones digestivas, a otros trastornos digestivos o simplemente a una lenta respuesta a la dieta sin gluten. Descartadas todas las posibilidades, habría que investigar, con pruebas más avanzadas, si se trata de un caso de EC refractaria.

Tratamiento
Control de la dieta sin gluten
El método habitual para monitorizar el buen cumplimiento de la dieta sin gluten, que es el análisis de anticuerpos específicos en sangre, si bien es válido para el diagnóstico, no lo es tanto para el seguimiento, ya que detecta las transgresiones con una sensibilidad del 53% y una especificidad del 83%. Es decir, una vez que los anticuerpos han desaparecido de la sangre tras el inicio de la dieta sin gluten, no siempre se vuelven a elevar ante ingestas accidentales de gluten. El análisis de péptidos inmunogénicos de gluten (GIP) en heces o en orina es, en cambio, una prueba fiable del consumo de gluten. Teniendo en cuenta que el consumo accidental de gluten no suele ser lineal, si no que probablemente se produce de manera intermitente según los hábitos alimenticios y sociales de cada persona, se considera más fiable el análisis en heces, que cubre un marco temporal más amplio (días) que la orina (horas), en palabras de Jocelyn Silvester (Boston, Estados Unidos).
Sobre el límite de gluten que puede ser tolerado por los pacientes, James Daveson (Brisbane, Australia) está llevando a cabo un estudio en su país para detectar la cantidad máxima de gluten tolerada por los pacientes, mediante ensayos ciegos en los que se administran diferentes cantidades de gluten o placebo a determinados intervalos de tiempo. La capacidad del gluten administrado para activar la respuesta inmunitaria se evalúa midiendo la interleuquina 2 (IL-2) en sangre. El motivo de este estudio es que la legislación en Australia y Nueva Zelanda no permite comercializar productos sin gluten si contienen cualquier cantidad de gluten detectable (3 mg/kg es el límite de detección actual), mientras que en Europa o Estados Unidos se admiten hasta 20 mg/kg como límite seguro, algo que además de suponer un posible riesgo para la salud según ellos dificulta el comercio internacional, al impedir la entrada de productos sin gluten con el criterio de las 20 partes por millón (ppm).
No es fácil predecir cuál va a ser la respuesta clínica de los pacientes ante ingestas accidentales de gluten. Peter Green (Nueva York, Estados Unidos) habló de la diferente sintomatología según la edad de la persona y también de su evolución en el tiempo. De entrada, su presencia y gravedad no guarda relación con el grado de lesión intestinal, como se ha comentado, y una vez instaurada la dieta sin gluten pueden reaparecer o dar paso a nuevos síntomas tras la ingesta accidental de gluten. Antes del diagnóstico, sumados a los síntomas específicos de la infancia o de la edad adulta, pueden estar presentes el dolor abdominal, la dermatitis herpetiforme, las aftas orales, los defectos en el esmalte dental, la neuropatía o alteraciones analíticas que incluyen el déficit de hierro, la anemia, el déficit de ciertas vitaminas, la hipoalbuminemia, la hipocalcemia, los niveles elevados de transaminasas y de amilasa, o niveles bajos de colesterol. Después del diagnóstico, son comunes el dolor de cabeza, la fatiga y la distensión abdominal tras el consumo accidental de gluten, aunque no guardan relación con una activación del sistema inmunitario, mientras que las náuseas y los vómitos, mucho menos frecuentes, sí reflejan una activación inmunitaria, evidenciada por la elevación de IL-2 en sangre tras ingerir gluten. Los mecanismos que generan los síntomas no están bien establecidos y se postulan como posibles causas el sobrecrecimiento bacteriano (SIBO), la intolerancia a azúcares (lactosa o fructosa), la intolerancia a carbohidratos fermentables (FODMAP), la insuficiencia pancreática o la colitis microscópica. Conocer el origen de los síntomas es importante no solo por el impacto que tienen para la calidad de vida de los pacientes, sino también de cara desarrollar fármacos para la EC, ya que las agencias del medicamento incluyen entre sus requisitos la resolución de los síntomas para dar el visto bueno a un nuevo medicamento.
Probióticos
El abordaje de la EC con probióticos es objeto también de investigación y es un tema que recapituló Natalie Yerlett (Londres, Reino Unido). La microbiota intestinal tiene múltiples funciones beneficiosas y necesarias para nuestro organismo. Degradan la fibra y los carbohidratos complejos que ingerimos, producen vitaminas, ácidos grasos de cadena corta y enzimas, generan ácido y sustancias antimicrobianas que previenen la invasión de posibles patógenos y contribuyen a mantener la integridad de la barrera intestinal, así como a modular la inmunidad. En EC existe disbiosis intestinal, desequilibrios también detectables en la microbiota oral, y existen bacterias tanto en la saliva como en el colon con capacidad de degradar el gluten generando fragmentos con diferente capacidad para hacer reaccionar de forma adversa nuestro sistema inmunitario. Especies bacterianas del género Pseudomonas generan péptidos más tóxicos, mientras que aquellas del género Lactobacillus reducen la toxicidad del gluten. El uso de probióticos para reequilibrar la microbiota intestinal se ha estudiado mucho sin alcanzar conclusiones claras sobre su efecto, al menos hay consenso en que no provoca efectos adversos detectables. Mientras esto se resuelve, la mejor estrategia consiste en mantener la diversidad de la microbiota por medio de una dieta variada que incluya fibra de manera fundamental junto a un estilo de vida saludable. Se aconseja garantizar la ingesta de alimentos naturales que aportan fibra (frutas, verduras, hortalizas y legumbres, además de cereales, sin gluten en el caso de la EC), que se consideran prebióticos, además de alimentos fermentados, que incluyen microorganismos.

Patologías asociadas y complicaciones
Autoinmunidad
Algunas enfermedades autoinmunes comparten determinantes genéticos, tienen mecanismos patogénicos comunes y son influidas por los mismos factores ambientales, por lo que no es raro que padecer una enfermedad autoinmune incremente el riesgo de manifestar alguna otra. Existe además la idea de que la incidencia de las enfermedades autoinmunes se ha incrementado en las últimas décadas. Para investigar esto, Nicoletta Nandi (Milán, Italia) evaluó la incidencia de 19 enfermedades autoinmunes entre 2000 y 2019 a partir de los registros sanitarios de 22 millones de ciudadanos del Reino Unido. Encontró que más de 1 millón de personas desarrolló una enfermedad autoinmune en ese periodo, y cerca de 900.000 personas desarrolló más de una enfermedad autoinmune. El mayor incremento en la incidencia de estas enfermedades se observó para la EC, la enfermedad de Graves (hipertiroidismo autoinmune) y el síndrome de Sjögren. El estudio reveló también que la mayoría de las enfermedades autoinmunes evaluadas era más frecuente en mujeres, salvo la diabetes tipo 1, la espondilitis anquilosante y la miastenia gravis, más comunes en varones.
Síndrome de Down
La EC afecta al menos al 6% de las personas afectadas por síndrome de Down (algunos estudios elevan la cifra hasta el 10% o incluso el 18%). Según expuso Marisa Stahl (Colorado, Estados Unidos), en muchos casos se realizan biopsias duodenales y se observan duodenitis e incluso atrofias vellositarias que no son debidas a la EC, sino a duodenitis péptica, sobrecrecimiento bacteriano, infecciones o a medicación. El 82% de los casos en los que se confirma la EC han sido detectados gracias a los cribados periódicos en estos pacientes, que empiezan a mostrar síntomas compatibles con la EC (en un tercio de los casos no son digestivos) hasta 3 años antes de ser diagnosticados. El tratamiento de la EC en estos pacientes se hace más complicado por la existencia de otras patologías asociadas, la necesidad de múltiples medicamentos y la rotación de las personas encargadas de su cuidado.
EC refractaria
El 15-30% de pacientes diagnosticados de EC muestran persistencia de síntomas y enteropatía tras 6-12 meses de dieta sin gluten aparentemente estricta, lo que encajaría en la definición de EC refractaria. Sin embargo, en el 95% de estos casos los síntomas persisten por los diferentes motivos expuestos anteriormente y encajan más en la denominada EC no respondedora. Solo 1 de cada 4 de estos casos son atribuibles verdaderamente al consumo inadvertido de gluten, que llega a detectarse incluso en el 5% restante de pacientes que sí encajarían en la definición de EC refractaria. Apoya el diagnóstico de EC refractaria una pérdida del 20% del peso corporal o más en pocos meses acompañada de malabsorción con hipoalbuminemia y anemia severa. Estos casos requieren tratamientos inmunosupresores que detalló Hugo Penny (Sheffield, Reino Unido).
Síndrome de intestino irritable y enfermedad celíaca
La asociación entre la EC y el síndrome de intestino irritable (SII) está descrita desde 2001. El SII se da con mayor frecuencia entre las personas con EC (2,7%) que en la población general (0,9%), pero la frecuencia de la EC es similar entre las personas con y sin SII, por lo que no existe recomendación de investigar la EC en pacientes con SII. En las personas diagnosticadas de EC, el SII es 2 veces más frecuente entre los malos cumplidores que entre los buenos cumplidores de la dieta sin gluten, 4 veces más frecuente entre los buenos cumplidores que entre las personas sanas y 12 veces más frecuente entre los malos cumplidores que entre las personas sanas, aseguró Carolina Olano (Montevideo, Uruguay). Son múltiples las posibles explicaciones a dicha asociación, como alteraciones en el eje intestino-cerebro, cuya interacción es bidireccional (la mitad de los pacientes celíacos presentan síntomas digestivos funcionales), la disbiosis intestinal, la inflamación de bajo grado, la persistencia de una permeabilidad intestinal aumentada, la intolerancia a carbohidratos fermentables (si es esta la causa, una dieta sin gluten baja en FODMAP durante 4 meses alivia eficazmente los síntomas) o la mucositis alérgica de contacto asociada a alimentos que contienen níquel, como el maíz. No es sencillo, en cualquier caso, diferenciar entre los problemas digestivos debidos a alteraciones en la interacción intestino-cerebro de aquellos asociados al consumo de alimentos con gluten, según expuso Nick Trott (Sheffield, Reino Unido).
Sobre la dieta baja en FODMAP en personas celíacas, Trott alertó del impacto que puede tener en la microbiota intestinal y en la dificultad que puede entrañar a los pacientes seguir una dieta tan restrictiva y lograr el aporte adecuado de los nutrientes requeridos. La justificación de esta dieta, según Leda Roncoroni (Milán, Italia), es el alto porcentaje de pacientes con síntomas de intestino irritable antes (hasta un 50%) e incluso después (30%-40%) de iniciar la dieta sin gluten. La dieta baja en FODMAP cobró popularidad a raíz de la publicación en 2010 de la primera guía para tratar el SII con esta dieta por parte de un equipo australiano. Una vez retirados los FODMAP, su reintroducción secuencial seguiría este orden: lactosa (lácteos), fructosa (frutas), fructanos (cereales y hortalizas), galactanos (legumbres) y polioles (verduras).
Para diferenciar entre EC y SII, María Esteve (Barcelona, España) presentó el linfograma intraepitelial como una buena herramienta, bastaría con analizar la proporción de linfocitos T intraepiteliales del subtipo gamma-delta en la biopsia, y para diferenciar entre sensibilidad al trigo no celíaca y SII, Aurelio Seidita (Palermo, Italia) valoró la calprotectina fecal como posible marcador diferencial, aunque concluyó que guarda más relación con un estado inflamatorio intestinal que con la presencia o ausencia de síntomas debidos a una u otra condición.

Síndrome de intestino irritable y sensibilidad al gluten/trigo no celíaca
Inés Pinto Sánchez (Ontario, Canadá) centró también su intervención en el SII. Antes considerado como un trastorno funcional, actualmente el SII se estudia más como una alteración del eje intestino-cerebro en la que están involucrados factores genéticos, ambientales (microbiota intestinal, infecciones) y psicológicos. Más del 80% de los pacientes que lo sufren asocian sus síntomas con la comida y en muchos casos los atribuyen al gluten tras haber ensayado dieta sin gluten por diferentes motivos (moda, noticias, medicinas alternativas, médicos, familiares, amigos, etc.). En estos casos, una vez descartadas la EC y la alergia al gluten o al trigo por ausencia de indicadores de autoinmunidad o de alergia, los síntomas de intestino irritable pueden ser causados por diferentes componentes del trigo y manifestarse como una intolerancia a los FODMAPS (carbohidratos fermentables como los fructanos del trigo), a una verdadera sensibilidad al gluten no celíaca (SGNC) o a una sensibilidad al trigo no celíaca derivada de la activación de la inmunidad innata en respuesta a los ATI (inhibidores de amilasa-tripsina). A la hora de prescribir dieta sin gluten en estos pacientes hay que valorar si realmente merece la pena, ya que incluso cuando está bien demostrado que la causa de los síntomas de intestino irritable es el gluten, la reintroducción a ciegas de gluten o placebo desencadena síntomas en un porcentaje importante de los pacientes tras ingerir el placebo ante la idea de que puede que lo que están consumiendo es gluten, lo que se denomina ‘efecto nocebo’, a la vez que no experimentan ningún síntoma si la sustancia ingerida es gluten. Esto se atribuye al componente psicológico del SII, que puede mermar el efecto positivo de la dieta sin gluten.
Federico Biagi (Pavia, Italia) duda de la SGNC, cuya prevalencia estimada en Estados Unidos es del 6% y del 15% en Australia. En su consulta no llega al 0,07%. Sólo considera una posible SGNC en pacientes en los que se ha descartado adecuadamente la EC y la alergia al gluten o al trigo, también otros trastornos digestivos, y sus pacientes creen que la comida puede tener relación con sus síntomas y apuntan al gluten, componente alimentario que él nunca menciona durante la evaluación de sus pacientes.
Para identificar la causa de los síntomas de intestino irritable asociados a alimentos, Detlef Schuppan (Mainz, Alemania) sugiere descartar primero la EC, la enfermedad inflamatoria intestinal y la alergia al trigo, para después plantearse si la reacción es debida al trigo, a la leche, a la soja o a la levadura. Estos componentes alimenticios han demostrado reactividad intestinal en pacientes con síntomas de intestino irritable al ser inyectados en la propia mucosa intestinal y observada la reacción en vivo mediante microscopía confocal. En el 50% de los casos es el trigo el agente responsable.
Autor: Juan Ignacio Serrano Vela. Doctor en Biología. Servicio de Investigación y Formación de la Asociación.